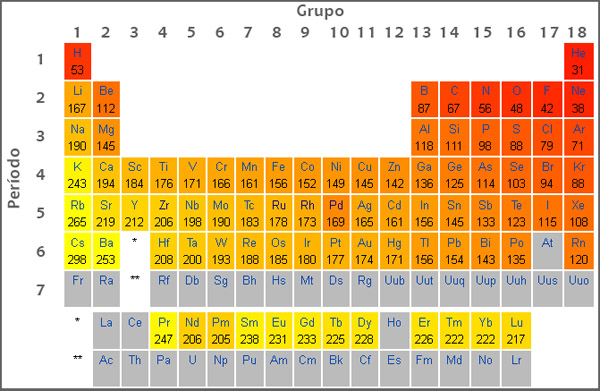
As formulas iônicas são uma forma de determinar o numero de íons em um aglomerado iônico, nas ligações iônicas dois íons de cargas opostas se atraem, conhecidos como cations e íons, cations são as cargas positivas enquanto íons são as cargas negativas, eles se atraem naturalmente pela eletrostática, em casos de substancias solidas esse se formam de maneira geométrica, um exemplo é o sal ele é formado pela transferência do elétron de sódio para o cloro o que vai dar origem ao cátion sódio (Na+) e o ânion cloreto (Cl–).
A formula de compostos iônicos ira indicar o numero mínimos de cations e íons o que forma um sistema eletricamente neutro, para ficar mais simples de entender, imagine um que em todos os elementos há uma ligação, para que ele se estabilize ele deve ceder ou receber cargas, essas cargas portanto serão negativas (íons) ou positivas (cations), elas entraram nesse processo até se estabilizarem, e a formula dos compostos iônicos ira apresentar a proporção minima dessas cargas.
Agora imagine como que um composto iônicos e formado por um numero x (indeterminado) de íons e cation, a formula para descobrir esse numero é geralmente a formula unitária que vai mostrar a proporção minima desses cations e íons para que o composto se neutralize e isso será possível pela troca dessas cargas entre os átomos.
Acompanhe o exemplo
O elemento alumínio tem três cargas positivas: Al3+
Enquanto isso o elemento Fluoreto contém uma carga negativa: F–
Para que os dois sejam neutralizados ou seja se igualem a zero seria necessário então três íons de Fluoreto, então podemos concluir que a formula seria AlF3.