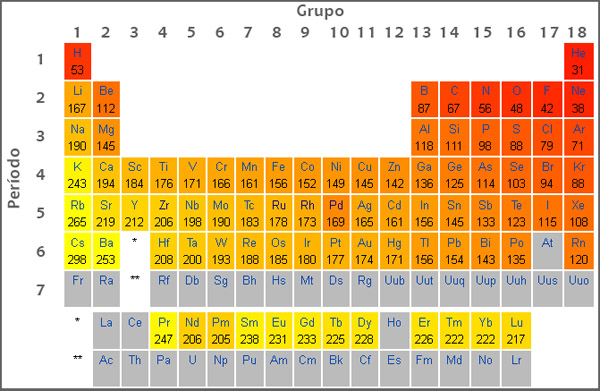
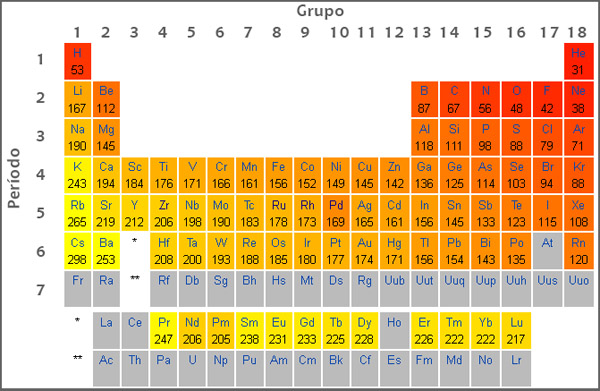
Na química, o chamado potencial de ionização é basicamente a quantidade de energia necessária para retirar o primeiro elétron da camada de uma átomo de algum elemento. Essa força vai aumentando gradativamente até o átomo mais próximo do núcleo, portanto o primeiro átomo, o mais afastado do núcleo é o que requer menor quantidade de energia. Para perder um elétron, o mesmo é usado como base para saber o potencial de ionização.
A camada de átomos, geralmente, é divida em ordem alfabética começando por “K”. Assim temos, K,L,M,N,O,P, etc. O elétron mais próximo do núcleo fica na chamada camada de valência. Ocasionalmente fazemos a distribuição eletrônica de acordo com o número atômico e para descobrir a camada de valência, os números atômicos 26 à distribuição ficaria 1s2 2s2 2p6 3s2 3p6 4s2 3d6, assim a camada de valência é a camada “4s²”.
Todos os números relacionados ao potencial de ionização estão presentes na tabela periódica. Os gases nobres são conhecidos por terem os maiores potenciais de ionização, os átomos que possuem baixo potencial de ionização acabam perdendo elétrons para se estabilizarem enquanto os átomos maiores como os gases nobres ganham elétrons para se adquirir mais estabilidade.